ИСАГУЛЯН Э.Д, ШАБАЛОВ В.А. ХРОНИЧЕСКАЯ ЭЛЕКТРОНЕЙРОСТИМУЛЯЦИЯ В ЛЕЧЕНИИ БОЛЕВЫХ СИНДРОМОВ. КРИТЕРИИ ДОЛГОСРОЧНОЙ ЭФФЕКТИВНОСТИ
ИСАГУЛЯН Э.Д, ШАБАЛОВ В.А. ХРОНИЧЕСКАЯ ЭЛЕКТРОНЕЙРОСТИМУЛЯЦИЯ В ЛЕЧЕНИИ БОЛЕВЫХ СИНДРОМОВ. КРИТЕРИИ ДОЛГОСРОЧНОЙ ЭФФЕКТИВНОСТИ
Isagulyan E.D., Shabalov V. A. Chronic Electroneurostimulation in the Treatment of Pain Syndromes. Criteria of Long term Effectiveness.
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН. Москва. Россия.
N.N. Burdenko Neurosurgical Institute, Russian Academy of Medical Sciences. Moscow Russian Federation.
Ключевые слова: нейростимуляция, электростимуляция спинного мозга, электростимуляция головного мозга, болевые синдромы.
Key Words: neurostimulation, Spinal Cord Stimulation, Motor Cortex Stimulation, Deep Brain Stimulation, Pain Syndromes.
Реферат
Одной из основных проблем современной медицины является проблема лечения нейрогенных болевых синдромов. Данная статья посвящена обзору современного состояния хирургии неврогенных болевых синдромов, которые являются наиболее сложными и часто приобретают медикаментозно-резситентные формы. В связи с этим хирургическое лечение этих болевых часто является неотъемлемой частью комплексного мультидисциплинарного лечения.
Хирургия болевых синдромов неонкологического происхождения представлена, прежде всего, методами нейромодуляции. Если при периферических нейрогенных болевых синдромах чаще применяется хроническая электростимуляция спинного мозга, то в лечении центральных болевых синдромов – хроническая электростимуляция глубинных структур и моторной коры головного мозга. В данной статье мы попытались обобщить имеющиеся в литературе данные по показаниям к обоим методам в лечении нейрогенной боли. Цель данной статьи – обратить внимание, прежде всего неврологов и врачей общей практики, на возможности современной функциональной нейрохирургии в лечении центральной нейрогенной боли. Однако необходимо помнить, что лечение тяжелых болевых синдромов должно быть комплексным, мультидисциплинарным.
Abstract
Chronic neuropathic pain is one of the most widespread problems of modern medicine. Among surgical methods of treatment of painful syndromes it is accepted to distinguish anatomic, destructive and not destructive operations (methods surgical neuromodulation). Anatomic operations have strictly certain indications and, unfortunately, not always promote elimination or simplification of the painful syndromes. Destructive interventions by virtue of their irreversible influence on the central nervous system and sets of complications now have lost the urgency and in the majority are replaced by methods of neuromodulation. Neuromodulation is minimal invasive operative interventions based on electrical and mediators influences on the various structures of nervous system. In this article we have considered the basic indications, contra-indications and selection criteria to application electroneurostimulation methods. There are briefly presented the techniques of implantation of the systems for chronic neurostimulation.
In the conclusion we hope for close cooperation of the neurologist, the neurosurgeon, the psychiatrist, neurophysiologist, and other adjacent specialists, for successful decision of this challenge.
Одним из главных достижений нейрохирургии последних десятилетий является переход от разрушительных, необратимых деструктивных операций к методам, которые оказывают модулирующее, корригирующее и, самое главное, обратимое воздействие на периферическую и центральную нервную систему. В качестве таковых в США, странах западной и восточной Европы, Японии, Китае, Израиле, Австралии и др. уже в течение 40 лет успешно применяются методы нейромодуляции. В течение последних 15 лет методы нейромодуляции применяются и в России.
Нейромодуляция – это терапевтического изменение активности центральной, периферической или вегетативной нервной системы посредством электрических или фармакологических воздействий с использованием имплантированных устройств.
Нейромодуляция подразделяется на два основных метода:
1) нейростимуляция — электрическая стимуляция (ЭС) структур периферической и центральной нервной системы с помощью имплантированных электродов и генераторов;
2) метод дозированного интратекального введения лекарственных средств с помощью имплантированных помп.
Последний метод чаще применяется в лечении онкологических болевых синдромов или при неэффективности нейростимуляции. В лечении тяжелых неонкологических болевых синдромов и, прежде всего, невропатических болевых синдромов, чаще применяются методы нейростимуляции. Последние принято подразделять на:
- ЭС периферических нервов (Peripheral Nerve Stimulation – PNS)
- ЭС спинного мозга (Spinal Cord Stimulation – SCS)
- ЭС глубинных структур головного мозга (Deep Brain Stimulation – DBS)
- ЭС центральной (моторной) коры головного мозга (Motor Cortex Stimulation – MCS) [12, 13, 20, 24, 25, 38, 40, 45].
Многолетние исследования в этом направлении доказали эффективность нейростимуляции. Наибольший интерес представляют факторы, влияющие на стабильность положительных результатов. Известно, что именно ухудшение результатов в катамнезе, является одним из камней преткновения на пути к более широкому распространению метода нейростимуляции.
Данные современной литературы и наш опыт свидетельствуют о том, что далеко не у всех больных результаты в катамнезе ухудшаются. Какие факторы могут влиять на стабильность полученного эффекта? Наконец, как избежать влияния отрицательных факторов и добиться не только стабильности, но и улучшения результатов?
Известно, что стабильных положительных результатов можно достигнуть только при строгом отборе пациентов и правильном выборе метода нейростимуляции [25, 36, 38].
Выбор метода нейростимуляции. До сих пор не проведено доказательного исследования, которое позволило бы определить отчетливые показания к PNS, SCS, DBSр или MCS [13, 25]. Тем не менее, существуют основополагающие принципы, руководствуясь которыми можно выбирать тот или иной метод нейромодуляции.
Эти принципы заключаются в следующем: от менее инвазивного к более инвазивному и от периферии к центру. Руководствуясь ими при выборе метода нейростимуляции вначале необходимо рассмотреть возможность применения PNS, затем SCS и, наконец, DBS или MCS.
Таким образом, при боли строго ограниченной зоной иннервации конкретного нерва логично применить ЭС данного периферическиого нерва, если, конечно, он доступен для минимальноинвазивного вмешательства.
Необходимо отметить, что за последние 7-10 лет к данному методу прибавился еще один очень важный метод нейростимуляции — ЭС области разветвления нервных окончаний одного или нескольких периферических нервов. Например, больной перенес герпес в области иннервации определенного межреберного нерва, но постгерпетическая невралгия не соответствует какому-либо конкретному нерву. Она охватывает область высыпаний, которые распространялись не вдоль межреберья, а перпендикулярно нескольким межреберьям. Вместо того, чтобы имплантировать 3-4 электрода по межреберьям, гораздо проще и правильнее имплантировать один электрод вдоль этой вертикальной «линии боли». Такой метод называется Periferic Nerve Field Stimulation, что дословно переводится как ЭС зоны иннервации (поля) периферического нерва. Возможно, правильнее говорить о подкожной ЭС ветвей определенных нервов.
Интересно, что именно данный метод, в отличие от практически всех других методов нейростимуляции (кроме DBS периакведуктального пространства — см. ниже) можно применять также и при ноцигенной, т.е соматогенной боли. Даже в лечении боли при артритах, некоторых видов острой боли, резистентной к консервативному лечению, можно применять данный метод ЭС [3, 13, 37, 45.] .
При болях в проекции одного или нескольких корешков, имеет смысл сразу подумать об SCS. Показанием к этому самому распространенному методу нейростимуляции являются боли в зоне иннервации определенных нервных корешков, при отсутствии их сдавления. Последнее обстоятельство всегда важно учитывать, чтобы не направлять больных с секвестрированными грыжами и выраженной нестабильностью позвоночного сегмента на SCS. При имеющихся признаках компрессии необходимо, прежде всего, эту компрессию устранить. Однако, здесь необходимо строго отграничить понятие «компрессии». Поскольку для некоторых нейрохирургов (как выясняется не только отечественных, но и, например, израильских), компрессией продолжает оставаться рубцово-спаечный эпидурит. Несмотря на многократно доказанную бесполезность и вредоносность любых операций по иссечению рубцовой ткани, многие клиники по-прежнему выполняют менинго-радикулолизы и подобные им операции. Даже сами пациенты, не сведущие в медицине, понимают, что на месте «удаленных» рубцов образуются новые. Но врачи по-прежнему предлагают такие операции, а пациенты соглашаются на них, некоторые по несколько раз.
Что касается ЭС головного мозга, то при некоторых патологиях уже намечается тенденция разделения показаний к DBS или MCS, а при других — данные методы пока остаются конкурирующими. Например, при болевой анестезии лица и других невропатиях и/или невралгиях тройничного нерва (особенно атипичных формах), а также при постинсультных болевых синдромах чаще применяется ЭС центральной коры головного мозга (противоположного боли полушария). При фантомных болевых синдромах также чаще применяется MCS. Однако, в некоторых случаях (в том числе и по нашим наблюдениям) DBS (VC и CmPf-ядра таламуса) тоже дает неплохие результаты.
При деафферентационных болевых синдромах, таких как, описанная выше болевая анестезия лица, постинсультная боль, боль после неполного преганглионарного повреждения корешков плечевого сплетения применяется MCS, противоположного боли полушария. Необходимо помнить, что, по сути, речь идет об ЭС моторной коры головного мозга, а это означает необходимость целостности (хотя бы частичной) двигательного пути. У больных с грубым моторным дефицитом в зоне боли данный метод не рассматривается.
Лучше всего методу MCS поддаются боли в лице различного происхождения. Это, прежде всего, боли не невралгического (приступообразного), а невропатического характера (постоянные или почти постоянные жгучие боли с периодическими усилениями или приступами на фоне постоянной боли). Такая боль нередко встречается на фоне рассеянного склероза. Кроме того, нередко при невралгической боли, т.е. при классической тригеминальной невралгии могут возникнуть определенные сложности или противопоказания к произведению микроваскулярной декомпрессии. В таких случаях тоже можно применять MCS. Необходимо помнить следующее: при боли невропатического характера в области одной или двух ветвей тройничного нерва можно вначале применить PNS. Если же боль распространяется на всю половину лица, или носит нестерпимый деафферентационный характер, или фоновая боль сопровождается приступами, то необходимо думать об MCS противоположного боли полушария головного мозга. Ни в коем случае нельзя применять PNS при приступообразном характере болей, даже если боль ограничена одной ветвью нерва.
Интрацеребральная стимуляция (DBS) сегодня применяется в основном при кластерной головной боли (перивентрикулярное серое вещество, задненижние отделы гипоталамуса). Однако за последние несколько лет накопилось немало сообщений [3, 13, 21, 23, 45] о достаточно высокой эффективности ЭС затылочных нервов (ONS — Occipital Nerve Stimulation) в лечении этого грозного вида головной боли. В связи со значительно меньшей инвазивностью, ONS должна применяться на первом этапе хирургического лечения кластерной головной боли, и только при ее неэффективности, можно рассматривать вариант DBS. Ранее DBS также нередко применяли при тяжелых, медикаментозно-резистентных соматогенных болях. Однако в настоящее время, в связи со все более широким распространением интратекального введения лекарственных средств, в частности, наркотических анальгетиков, местных анестетиков и блокаторов кальциевых каналов (Зиконотид), показания к DBS при соматогенных болях ограничены [3].
Таким образом, алгоритм применения методов нейростимуляции можно представить следующим образом:
1) при поражении периферических нервов и отсутствии признаков деафферентации на первом этапе следует применять PNS;
2) при поражении корешков без признаков деафферентации — SCS;
3) при поражении корешков с неполным их отрывом от спинного мозга, но с явными признаками деафферентации — MCS;
4) при центральных болевых синдромах (поражение спинного и головного мозга, фантомные боли) — MCS;
5) при фантомно-болевом синдроме, кластерной головной боли, резистентной к ONS — DBS.
Критерии отбора пациентов. За 30 лет применения нейростимуляции в мировой литературе накоплено достаточно материала, проанализировав который, и сопоставив его с полученными нами данными, мы попытались выделить факторы, влияющие на стабильность результатов в катамнезе. Эти прогностические факторы можно разделить на клинические (I) и тестовые (II).
I. По данным большинства авторов среди клинических факторов, влияющих на долгосрочность результатов выделяются следующие:
- Длительность болевого анамнеза [17, 34]
- Количество операций, выполненных до применения методов нейромодуляции [15, 48]
- Характер самого болевого синдрома [17, 43]
- Характер заболевания (злокачественное, прогрессирующее или относительно стабильное, доброкачественное) [25]
- Психологический статус пациента [17, 22, 43].
1, 2. Результаты SCS тем хуже, чем длительнее анамнез, чем больше произведено оперативных вмешательств анатомического характера и чем больше времени прошло после последней такой операции [15, 34, 41, 42, 48].
Мы произвели подобное сравнение в нашей группе пациентов с синдромом оперированного позвоночника и представить эту зависимость в графическом виде (рис.1).
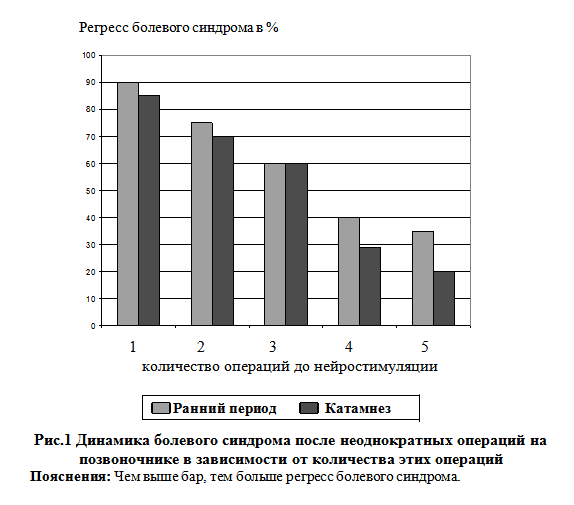
Как видно из диаграммы, между количеством операций до нейростимуляции и эффективностью последней наблюдается практически линейная зависимость.
Вероятнее всего, это обусловлено более грубым рубцово-спаечным процессом, нарушением кровообращения, склеротическим перерождением неоднократно травмированных паравертебральных мышц, внутриствольным перерождением корешков и т. д.
3. Каким образом характер болевого синдрома может влиять на эффективность нейростимуляции? Прежде всего, необходимо помнить, что нейростимуляции лучше поддаются нейрогенные, чем соматогенные боли [15, 38, 40, 42, 48]. Поэтому необходимо строго дифференцировать наличие нейрогенного компонента в любой, даже сложной картине болевого синдрома. Существуют основные признаки нейрогенной боли, неоднократно описанные в различных руководствах, как отечественных, так и зарубежных авторов [1, 6, 11, 16, 27, 36, 44]. Основным клиническим проявлением деафферентационной боли является болевая анестезия (“anesthesia dolorosa”).
Анализ полученных нами результатов, показал, что отрицательные результаты и все случаи с отрицательной динамикой в катамнезе (при применении PNS и SCS) наблюдались, прежде всего, у пациентов с явными признаками деафферентационной боли.
Наиболее характерные признаки деафферентационной боли следующие:
- У всех больных с деафферентационной болью в анамнезе и по данным параклинических методов исследования был подтвержден полный перерыв крупных нервных стволов, отрыв корешков или повреждение спинного мозга.
- Распространение зон боли за пределы первоначального источника с развитием КРБС.
- Выраженность фоновой боли, аллодинии и гиперпатии, достигающих по интенсивности выраженности пароксизмов.
- Крампиподобный (сдавливающий) характер пароксизмальной боли; в отдельных случаях они напоминали выдергивание, выкручивание конечности.
- Выраженные симптомы выпадения (как моторные, так и сенсорные и вегетативные).
- Резистентность к анальгетикам или извращенная реакция на их применение.
По признаку деафферентации, нейрогенный болевой синдром разделяют на две группы:
- нейрогенные болевые синдромы с явными признаками деафферентации и
- нейропатические болевые синдромы без явных признаков деафферентационного болевого синдрома.
Мы сравнили результаты лечения в этих двух группах. Эффективность SCS оказалась намного выше в группе пациентов без явных признаков деафферентации.
4. Прогрессирующее течение основного заболевания, вызывающего тяжелый болевой синдром, может существенно влиять на эффективность нейромодуляции в катамнезе. Это требует более частого изменения параметров ЭС.
Для иллюстрации влияния характера заболевания на результаты нейростимуляции приведем следующий клинический пример:
Больной А. 42 лет, с фантомным болевым синдромом, возникшим после экзартикуляции левого бедра по поводу саркомы бедренной кости. Выраженность болевого синдрома прогрессивно нарастала. Боль была практически постоянной «ноющего» «сдавливающего», и «жгучего» характера. На фоне постоянной боли в 6 – 8 баллов по визуально-аналоговой шкале (ВАШ) возникала пароксизмальная боль (9 – 10 баллов по ВАШ) по типу «скручивания», «отрывания конечности» «разрывания внутри ноги снаряда». Такие приступы возникали у больного до 5 раз в сутки и длились от нескольких минут до нескольких десятков минут.
Приступ чаще всего провоцировался дефекацией, из-за чего больной старался меньше есть и страдал запорами. Из-за сильных болей пациент большую часть дня проводил в постели. Ненаркотические анальгетики, а также сочетание их с психотропными препаратами эффекта не давали. На момент поступления в НИИ нейрохирургии больной принимал Омнопон в инъекциях до 3 раз в сутки. Из-за постоянно присутствующего фона наркотических препаратов в психическом статусе больного обращала на себя внимание некоторая заторможенность, смазанность речи. Пациент астенического телосложения. Соматически компенсирован. В неврологическом статусе выпадений не отмечено. Учитывая характер болевого синдрома (центральный), больному произведена имплантация электродов в сенсорные и неспецифические ядра таламуса справа.
Выбор точки цели был обусловлен с одной стороны фантомным (деафферентационным) характером боли и наличием выраженного психического компонента в общей картине болевого синдрома и, с другой стороны, узкой локализованностью боли (только в ноге). Стоит отметить, что на момент поступления данного пациента в (2002 году), метод MCS был в начальной фазе своего развития и нами еще не был освоен.
Операция проводилась по стандартной стереотаксической методике с рамной навигацией по данным КТ головного мозга и интраоперационной ЭС. Во время операции было достигнуто полное покрытие парестезией всей фантомной ноги.
Уже через несколько минут после интраоперационной ЭС больной отметил уменьшение выраженности фоновой боли. В течение последующих 2 суток не наблюдалось приступов пароксизмальной боли. За год после экзартикуляции бедра больной впервые спокойно уснул и не просыпался от боли.
В течение всего тестового периода на фоне ЭС у пациента не наблюдалось приступов сильной боли. Возникающие пароксизмы не превышали 3 балла по ВАШ. Начиная с первых суток тестового периода, больной полностью отказался от анальгетиков. На приведенном «профиле боли» (рис. 2А) видно как изменились другие показатели влияния боли на качество жизни.
Учитывая положительные результаты тестового периода, произведена имплантация двухканального нейростимулятора. В течение 10 дней после операции были найдены оптимальные параметры ЭС (амплитуда на обоих каналах 2,0 V; длительность импульса 210 µsec; частота 130 Hz) и больной выписался в удовлетворительном состоянии.
Среди других параметров качества жизни следует отметить, что пациент вернулся к работе и, будучи инвалидом первой группы, но без сильной боли, мог водить такси. Отличный результат сохранялся в течение года. При контрольном исследовании в онкологическом отделении по месту жительства был выявлен продолженный рост опухоли и произведена операция по удалению опухоли с резекцией костей таза и удалением регионарных лимфоузлов.
После операции возобновились интенсивные боли, которые не купировались ЭС на фоне приема анальгетиков, среди которых вновь появились наркотические. Сразу после выписки из онкологического стационара в НИИ нейрохирургии произведены изменения в программе ЭС, на фоне которой удалось вновь достичь прежнего эффекта стимуляции. Больной отказался от аналгетиков, стал снова работать.
Однако спустя месяц боль вновь начала усиливаться. Произведено новое перепрограммирование системы. В этот раз, при крайне интенсивной боли только стимуляции оказалось недостаточно. Пациент начал принимать МСТ (пероральная форма морфина) 1 таблетку на ночь 1 – 2 раза в неделю. По другим показателям «профиль боли» изменился незначительно (рис. 2Б) и оставался стабильным в течение дальнейшего катамнестического наблюдения (3 года).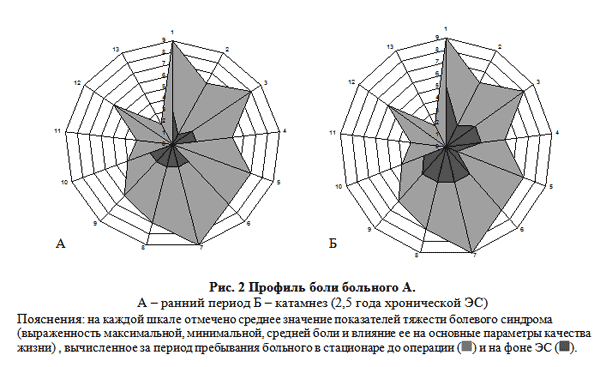
Таким образом, отрицательная динамика в данном случае была, вероятнее всего, обусловлена прогрессированием заболевания. Определенное влияние на общую картину болевого синдрома, безусловно, оказывала реальная самооценка своей перспективы и безвыходности положения в связи с тяжелым диагнозом. Данный пример также наглядно иллюстрирует динамичность метода хронической ЭС – возможность изменять клинический эффект в зависимости от изменений тяжести болевого синдрома в процессе развития хронического заболевания.
5. Одним из самых важных этапов обследования пациента является полное нейропсихологическое исследование, как для исключения или подтверждения невротических расстройств, так и для определения астено-депрессивного компонента, который в той или иной степени присутствует в картине практически любого болевого синдрома. Это позволяет определить показания и протипоказания к имплантации нейростимулятора, а также выяснить необходимость и объем дальнейшей медикаментозной и/или нейропсихологической коррекции в послеоперационном периоде.
Как отмечал R. Yang [52], «Если больному необходима психологическая помощь, без нее он не получит стойкого удовлетворительного результата, какой бы из известных методов лечения не применялся».
Тесное сотрудничество между врачом, производящим имплантацию систем для нейростимуляции и членами мультидисциплинарной команды врачей (в которую входят невролог, алголог, нейропсихолог, психоневролог, нейрофизиолог, реабилитолог) является залогом повышения эффективности лечения и достижения более устойчивых, долгосрочных результатов [26].
II. В настоящее время для прогнозирования исхода лечения методом нейростимуляции применяются следующие тесты:
- ЧЭНС – чрескожная электронейростимуляция
- ТКМС – транскраниальная магнитостимуляция
- Тестовая периоперационная ЭС
1. Тестовая чрескожная электростимуляция (ЧЭНС) чаще применяется для предоперационной оценки анальгетического воздействия ЭС на периферических нервах.
2. Тестовая транскраниальная магнитостимуляция, благодаря свойству магнитного поля проникать через определенный слой мягких тканей, может оказывать анальгетический эффект.
Как ЧЭНС, так и ТКМС могут служить лишь относительными предикторами результатов ЭС. Единственным методом, достоверно коррелирующим с результатами хронической стимуляции является тестовая периоперационная ЭС.
3. Тестовая интраоперационная ЭС является методом непосредственного контроля уровня анальгезии во время операции. Поэтому ее результаты в большинстве случаев отчетливо коррелируют с ранним послеоперационным эффектом. К сожалению, не всегда во время операции удается получить отчетливое обезболивание. В таких случаях необходимо получить парестезию в зоне, максимально охватывающей область боли, а дальнейшая тактика будет зависеть от тестового послеоперационного периода. Кроме того, иногда приходиться оперировать больных под общим наркозом (больные с тяжелой сопутствующей патологией, особенности доступа, одномоментные операции вместе со стабилизирующими операциями на позвоночнике и др.). В этих случаях дальнейшая тактика решается только на основании результатов послеоперационного тестового периода.
Опыт большинства хирургов, и наш собственный, указывает на обязательное проведение послеоперационного тестового периода до окончательной имплантации всей системы [14, 15, 17, 25, 42, 48].
Можно ли улучшить результаты при длительном катамнестическом наблюдении? В современной литературе за последние 20 лет применения нейростимуляции мы не нашли прямых указаний на улучшение результатов в катамнезе.
Улучшение результатов SCS в катамнезе мы наблюдали у пациентов, которые самостоятельно и методично подбирали программу ЭС, периодически изменяя ее в зависимости от перемены внутренних и внешних условий.
Положительную динамику в течение периода катамнестического наблюдения мы наблюдали у 15 больных.
При длительной хронической ЭС иногда может возникать так называемый «феномен привыкания». Чаще он возникает при использовании ЭС на одной и той же частоте. Поэтому изменение только этого параметра во многих случаях бывает достаточным для восстановления эффекта [31, 34]. Кроме того, интенсивность и характер боли могут меняться в зависимости от внешних (например, погодных), и внутренних (психоэмоциональное состояние) условий, что также требует некоторой коррекции программы стимуляции.
Во всех случаях с положительной динамикой, улучшение в катамнезе, по всей вероятности, имело место в связи с активным самостоятельным поиском (самим пациентом) оптимальной программы ЭС и дальнейшим периодическим перепрограммированием системы.
Перепрограммирование системы позволяет приспособить условия стимуляции к изменяющимся внешним и внутренним условиям, влияющим на интенсивность боли. Помимо этого периодическая смена программы позволяет избежать привыкания к одним и тем же параметрам ЭС. Учитывая эти обстоятельства, в течение последних 10 лет выпускаются системы, в которых можно заранее запрограммировать до нескольких десятков программ. Пациент может переключать программы одной — двумя кнопками на пульте управления системой, предназначенного для пациента.
Заключение. Учитывая высокую эффективность и малую травматичность метода нейростимуляции, а также возможность контролирования обезболивающего эффекта в катамнезе, его всегда можно использовать на одном из первых этапов хирургического лечения больных с нейрогенными болевыми синдромами. Однако необходимо строго соблюдать критерии отбора, показания и противопоказания во избежание заведомо отрицательных результатов уже в раннем послеоперационном периоде.
Необходимо еще раз подчеркнуть, что лечение тяжелых болевых синдромов остается сложной как медицинской, так и социальной проблемой. Несмотря на наличие множества факторов, определяющих эффективность лечения, наверное, ключевым их них является мультидисциплинарный подход к диагностике и лечению хронических болевых синдромов.
Пути решения этой проблемы привели к развитию отдельной науки – алгологии и развитию клиник и центров лечения боли по всему миру. Их организация основывается на мультидисциплинарном подходе, поскольку опыт последних десятилетий убедительно показал, что в лечении тяжелых болевых синдромов не существует единственного эффективного метода – лечение должно быть комплексным.
Необходимо подчеркнуть, что в комплексе лечения тяжелых болевых синдромов требует более тесного сотрудничества неврологов, алгологов, нейропсихологов, психоневрологов, функциональных нейрохирургов, а также врачей смежных специальностей.
Список литературы
- Алексеев В.В., Яхно Н.Н. Боль. – В кн.: Болезни нервной системы: Руководство для врачей/Под ред. Н.Н. Яхно и Д.Р. Штульмана. – М.: Медицина – 2001. – Т.1. – С. 106 – 124.
- Бехтерева Н.П., Камбарова Д.К., Поздеев Л. Устойчивое патологическое состояние при болезнях мозга. Л.: Медицина, 1978. 185 с.
- Зеелигер А., Берснев В.П. Нейромодуляция при хронических болевых синдромах различного генеза.//Санкт-Петербург.: 2010 – 247 с. с илл.
- Кандель Э.И. // Функциональная и стереотаксическая нейрохирургия. // Москва. «Медицина». 1981
- Кандель Э. И. Современная хирургия боли // ВНИИМИ.: М, 1986. — 72 с.
- Крыжановский Г. Н. Общая патофизиология нервной системы. Руководство. -М.: Медицина, 1997. — 322 с.рыжановский Г.Н. Центральные механизмы патологической боли // Журн. неврологии и психиатрии им. С.С.Корсакова. — 1999. — Т.99, №12. — С.4-7
- Крыжановский Г.Н. «Физиологическая и патологическая боль» Научно-практический журнал «Патогенез» 1, 2005, с.14
- Кукушкин М.Л., Хитров Н.К. «Общая патология боли», М.: Медицина, 2004.- 144 с.
- Лившиц А. В. Хирургия спинного мозга — — М., 1990
- Нинель В. Г. Электростимуляция спинного мозга в лечении тяжких болевых синдромов туловища и конечностей нейрогенной природы: Дис. … д-ра мед. наук. — М., 1994 — 304с.
- Шабалов В.А. Функциональная нейрохирургия. Лечение тяжелых болевых синдромов // Клиническая неврология под редакцией акад. РАН и РАМН А.Н.Коновалова // ТIII, Ч2, Гл 68, стр.403 – 419, М,2004
- Шабалов В.А. Функциональная нейрохирургия. Общие положения// Клиническая неврология под редакцией акад. РАН и РАМН А.Н.Коновалова // ТIII, Ч2, Гл 63, стр.371 – 381, М,2004
- Шабалов В.А., Исагулян Э.Д.. Руководство для врачей: «Что делать с трудной болью. Электростимуляция спинного и головного мозга в лечении хронической неонкологической боли».// М.:ООО «Реал-Графика», 2008 – 102 с. с илл.
- Шабалов В.А., Исагулян Э.Д. Хроническая электростимуляция спинного мозга в лечении нейрогенных болевых синдромов. // Журнал вопросы нейрохирургии им. Н.Н.Бурденко. 2005: 4, стр. 11-18.
- Barolat Giancarlo, M.D. and Ashwini D. Sharan, M.D./ Spinal Cord Stimulation for Chronic Pain Management / Seminars In Neurosurgery/Volume 15, Numbers 2/3 2004
- Bennett M. The LANSS pain scale: the Leeds assessment of neuropathic symptoms and signs. // Pain — 2001. — Vol. 92. — P. 147-157.
- Block AR. Psychological screening of spine surgery candidates: risk factors for poorer outcome. In: Loeser JD Ed. Lippincott, Williams and Wilkins, 2000: 1549-57;
- Bonica J. J. Management of Pain ( 3rd Edn) London: Lippincott, Williams and Wilkins, 2000: 1549-57;
- Broseta J, Barbera J, de Vera JA, et al. Spinal cord stimulation in peripheral arterial disease. A cooperative study. J Neurosurg 1986;64:71–80
- Brown JA, Barbaro NM. //“Motor cortex stimulation for central and neuropathic pain: current status.”// Pain. 2003 Aug;104(3): 431
- Burns B,Watkins L, Goadsby PJ, Treatment of medically intractable cluster headache by occipital nerve stimulation: long-term followup of eight patients, Lancet, 2007;369(9567):1099 1106
- Daniel MS, Hutcherson MS, Hunter S. Psychological factors and outcome of electrode implantation for chronic pain. Neurosurgery 1985;17:773–777
- Dodick DW, Occipital nerve stimulation for the chronic cluster headache, Advanced Studies in Medicine, 2003;3(6C):S569 71.
- Ebel H, Balogh A, Volz M: Augmentative treatment of chronic deafferentation pain syndromes after peripheral nerve lesions. Minim Invasive Neurosurg 43:44–50, 2000
- Gybels J., S. Erdine; J. Maeyaert;B. Meyerson;J.-P. Van Buyten, et al (EFIC) Neuromodulation of Pain//A consensus statement prepared in Brussels 16–18 January 1998 by the following Task Force of the European Federation of IASP Chapters//European Journal of Pain 1998 2: 203–209
- Gybels JM, Kupers RC. Brain stimulation in the management of persistent pain. In: Schmidek HH, eds. Operative Neurosurgical Techniques. Philadelphia: WBSaunders; 2000:1639–1651
- Jensen T.S., Baron R. Translation of symptoms and signs into mechanisms in neuropathic pain//Pain-2003.-Vol. 102.-P. 1-8.
- Helen Smith, R.G.N., Carlolf Joint, R.G.N., David Schlugman, F.R.C.A., Dipankar Nandi, M.Ch., John F. Stein, F.R.C.P., Tipu Z. Aziz, //Motor Cortex Stimulation for Neuropathic Pain// Neurosurg Focus 11(3), 2001
- Horsch S, Claeys L. Epidural spinal cord stimulation in the treatment of severe peripheral arterial occlusive disease. Ann Vasc Surg 1994;8:468–474
- Katayama. Y., Yamamoto. T., Kobayashi. K., Kasai, M.. Oshima, H.. and Fukaya. C. (2001) // Motor cortex stimulation for phantom limb pain: a comprehensive therapy with spinal cord and thalamic stimulation. // Stereotact. Funct. Neurosurg., 77: 159 — 161.
- Katayama Y. “Deep brain stimulation therapy: control of human brain function by chronically implanted electrodes” No To Shinkei. 2000 Apr;52(4):297-305
- Kumagai Y, Taga K, Hokari T, Fujioka H, Matsuki M, Shimoji K, Homma T, Tsutsui T, Takeshita H, Tsuji C, et al // The effect of DREZ (dorsal root entry zone) lesions on intractable pain in patients with spinal cord injury.[Article in Japanese] // Masui 1990 May;39(5):632-8
- Kumar K, Toth C, Nath R. Deep brain stimulation for intractable pain: a 15-year experience. Neurosurgery 1997;40: 736–747 (76)
- Kumar K, Toth C, Nath RK, Laing P., //Epidural spinal cord stimulation for treatment of chronic pain—some predictors of success. A 15-year experience. // Surg.Neurol. 50(2):110-20; discussion 120-1, 1998.
- Levy RM Deep brain stimulation for the treatment of intractable pain Neurosurg Clin N Am. 2003 Jul; 14 (3):389-99
- Loeser DJ, Bulter, Chmapman and Turk Eds. Bronica Management of Pain 3rd Edition. Lippincott, Williams & Wilkins, 2001 pp. 1540-1549
- Mitchell, Bruce FACSM; Vivian, David; Verrills, Paul; Sinclair, Chantelle// Peripheral Nerve Field Stimulation: A Novel Treatment for Chronic Pain.: Medicine & Science in Sports & Exercise: May 2008 — Volume 40 — Issue 5 — pp S4-S5
- Meyerson B. A. Neurosurgical approaches to pain treatment. Acta Anaesthesiologica Scandinavica Volume 45 Issue 9 Page 1108 — October 2001
- Nagaro T, Kimura S, Arai T. A mechanism of new pain following cordotomy; reference of sensation. Pain. 1987 Jul;30(1):89-91
- Nguyen .IP. Lefaucher JP, Le Guerinel C. et al // Motor cortex stimulation in the treatment of central and neuropathic pain.// Arch Med Res 31:263-265, 2000
- North RB, Campbell JN, James CS, et al Failed back surgery syndrome: five-year follow-up in 102 patients reoperation. Neurosurgery 1991; 28: 685-91
- North, R.B., Kidd, D.H., Zahurak, M., James, C.S. and Long, D.M. /Spinal cord stimulation for chronic, intractable pain: experience over two decades. /Neurosurgery 32:384-394, 1993.
- Price DD. Psychological and neural mechanisms of the affective dimension of pain. Science 2000;288:1769-72
- Richter R.W. et al 5th international Conference on the Mechanisms and Treatment of Neuropathic Pain. 2002; Dworkin R. Et al J Pain 2004; 5 (suppl 1). 58
- Slavin K. Peripheral nerve and field stimulation. Neurotherapeutics, Volume 5, Issue 1, Pages 100-106, January 2008.
- Shealy CN, Mortimer JT, Reswick JB: Electrical Inhibition of Pain by Stimulation of the Dorsal Columns, Anesth. Analg curr. Res. 46:299-304, 489-491, 1967).
- Tasker RR. History of lesioning for pain. Stereotact Funct Neurosurg 2001;77:163-5
- Tracy Cameron, Ph.D. Safety and efficacy of spinal cord stimulation for the treatment of chronic pain: a 20-year literature review Department of Biomedical Engineering, University of Texas Southwestern Medical School, Dallas; and ANS, Inc., Plano, Texas J Neurosurg (Spine 3) 100:254–267, 2004
- Tsubokawa T, Katayama Y, Yamamoto T, et al // Chronic motor cortex stimulation for the treatment of central pain. // Acta Neurochir Suppl 52:137-139, 1991
- Wall P.D., Gutnick M. Ongoing activity in peripheral nerves: the physiology and pharmacology of impulses originating from a neuroma // Exp. Neurol. -1974.-Vol. 43. P. 580-593.
- Wallace BA, Ashkan K, Benabid AL. “Deep brain stimulation for the treatment of chronic, intractable pain”. Neurosurg Clin N Am. 2004 Jul;15(3):343-57
- Young R. F. Deep-Brain Stimulation for the Treatment of Chronic Pain Current Science1997, 1:182-191
Расскажите о себе
Прежде чем записываться на консультацию Вы можете выслать краткую историю своего заболевания, а также отсканированные снимки МРТ, КТ и данные других методов исследования. Это позволит сэкономить Ваше время и избежать повторных дополнительных обследований.